伊川班の論文がPNAS.に掲載されました
2023.03.02
伊川班の論文がPNASに掲載されました。
IZUMO1やSPACA6といった哺乳類の精子先体膜に存在するタンパク質は、精子と卵の結合や融合において必須の役割を果たすことが知られています。初期円形精子細胞では、多くの先体タンパク質前駆体が小胞体で合成・修飾され、ゴルジ体に輸送された後に前先体小胞として分泌され、先体を形成します。しかし、これらのタンパク質の生合成が精子形成過程でどのように制御されるのかはほとんど分かっていませんでした。
伊川班のLuさんらは、この制御を担う因子として、精巣特異的なII型膜貫通タンパク質であり、円形精子細胞に多く発現する小胞体タンパク質1700029I15Rikに着目しました。雄の1700029I15Rik ノックアウト(KO)マウスは、精巣重量や精子の形態、数、運動性に問題がないにも関わらず、不妊となりました。また、体外受精解析の結果、1700029I15Rik KO精子は、先体反応を起こし、卵の透明帯を通過し卵膜と結合するものの、卵と融合できませんでした。さらにLuさんらは、精子の卵融合能消失の仕組みを探るため、精巣における1700029I15Rik相互作用タンパク質の網羅的同定を行い、31種類のタンパク質を見出しました。この中には、タンパク質のN−グリコシル化に関わるオリゴ糖転移酵素(OST)複合体サブユニットが含まれており、1700029I15Rikがこれらのタンパク質と相互作用し、安定化していることを示しました。これに関連して、1700029I15Rik KO精巣では、N−グリコシル化を受ける先体膜タンパク質であるIZUMO1、EQTN、SPACA1、SPACA6などの発現が減少したものの、KO 精子ではSPACA6の減少のみが顕著でした。最後に野生型精子とKO 精子のプロテオーム比較により、KO精子ではミスフォールドタンパク質の異常蓄積により、ユビキチン化タンパク質とユビキチン依存性ER関連分解(ERAD)経路のタンパク質が増加することを見出しました。
これらの結果から、1700029I15Rikは円形精子細胞においてOST複合体を安定化することにより先体膜タンパク質のN−グリコシル化を促進し、フォールディングを含むタンパク質のプロセシングを特異的に制御していることが明らかにされました。1700029I15Rikはヒトで高度に保存されていることから、今回の発見は、特発性男性不妊症の病因究明や、非ホルモン避妊法の開発に繋がることが期待されます。
以下、質問です。
1. 精子の受精能制御の仕組みを解析するにあたり、1700029I15Rikという機能未知因子に着目した経緯を教えていただけますでしょうか。
(Lu) 我々は、CRISPR/Cas9を用いて精巣特異的発現遺伝子を網羅的にノックアウトしています。その過程で、雄性不妊を示した1700029I15Rik KOマウス精子が、卵と融合できないことに注目しました。さらに興味深いことに、このタンパク質は成熟精子には存在しませんでした。このことから、1700029I15Rikタンパク質は、配偶子融合に必須な先体膜タンパク質の生合成を促進する役割を担っていると考えました。
2. 1700029I15Rikの相互作用因子を同定する共免疫沈降−質量分析では、biological replicate間に同定タンパク質の違いがあるようでした(論文Fig. 4A)。この解析にあたり難しかった点、苦労した点を教えていただけますでしょうか。
(Lu) マウス精巣における1700029I15Rikのタンパク質量が少ないため、SDS-PAGE分解、銀染色した共沈タンパク質複合体に野生型精巣サンプルに特有の顕著なタンパク質バンドは検出できませんでした。これは、1700029I15Rikおよび相互作用タンパク質が微量であり、プロテオームを正確に検出することが難しいためであると考えました。そこで、タンパク質の検出の信頼性を高めるために、3回の生物学的複製で共沈/質量分析を行うことにしたところ、なんとか候補因子を得ることができました。
3. 野生型マウスとKOマウスの精巣全体でのタンパク質比較と、精子のタンパク質比較では、その量的変動の傾向は大きく異なり、KO精巣では多くの先体膜タンパク質の発現低下が見えましたが、KO 精子ではSPACA6の発現低下のみが顕著でした(論文Fig. 4Fと4H)。このような精巣と精子の結果の違い、およびSPACA6発現変動傾向が他の先体膜タンパク質と異なる理由について説明をお願いできますでしょうか。
(Lu) 精巣には細胞質が豊富な精子細胞と細胞質が殆どない精子が混在しています。私達は、精子形成の初期に小胞体で過剰に合成された先体膜タンパク質は、ごく一部が先体膜に取り込まれて最終的に成熟精子に保持される一方、殆どは精子形成過程で捨てられると考えています。つまり精巣のウェスタンブロット解析は、細胞質が豊富な精子細胞の量を反映するため、精巣内精子のSPACA6が減っていても差が検出できていないと考えています。
他の融合関連雄性因子(例えばIZUMO1、TMEM95;図4I)を欠くマウス精子では、SPACA6が顕著に減少しました。KO雄マウスではSpaca6の転写レベルに影響がないことから(図S8B)、精子SPACA6量はこれらの因子に強く依存していると結論づけました。したがって、1700029I15Rik KO雄では、複数の先体膜タンパク質の生合成が損なわれることで、直接もしくは間接的にSPACA6のタンパク質分解が引き起こされる可能性があると考えます。
4. 1700029I15Rikは哺乳動物間で広く保存されていることが示されています(論文Fig. 1C, D)。この因子やOST複合体などの相互作用因子、N−グリコシル化修飾により制御を受けると考えられるIZUMO1やSPACA6などの因子の進化的保存性から鑑みて、今回提唱した仕組みはどの程度、他の生物種の配偶子融合機構に適用可能であると考えられるでしょうか。
(Lu) 融合関連雄因子であるIZUMO1やTMEM95は、ヒト、ウシ、げっ歯類において配偶子融合に関与することが証明されています。また、1700029I15RikのオルソログであるC11orf94のヒト精巣でのタンパク質発現を確認しています(下図:未発表データ)。これらの関連タンパク質が進化的に保存されていることから、精子の先体形態が多様であるにもかかわらず、このタンパク質生合成経路は哺乳類でも保存されていると考えています。今後、他のモデル動物での遺伝子編集技術や標的タンパク質の分解技術などを用いて、この考えを検証したいです。
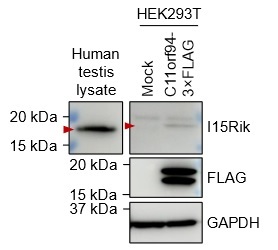
図.ヒト精巣および過剰発現HEK293T細胞におけるC11orf94の検出。
(回答:大阪大学・Lu Yonggang)
(東北大学・林 陽平)
1700029I15Rik orchestrates the biosynthesis of acrosomal membrane proteins required for sperm-egg interaction.
Lu Y, Shimada K, Tang S, Zhang J, Ogawa Y, Noda T, Shibuya H, #Ikawa M.
Proc Natl Acad Sci U S A. 2023 Feb 21;120(8):e2207263120. doi: 10.1073/pnas.2207263120. Epub 2023 Feb 14.